Introduzione
Il tumore del colon-retto (CRC) è uno dei più frequenti tumori, causa di un elevato numero di interventi chirurgici, terapie e morti. Nasce dal colon, la parte terminale dell’intestino che si estende per circa un metro tra l’intestino tenue e l’ano. Proprio perché così frequente e grave è anche uno dei tumori più studiati; le conoscenze sul CRC sono oggi molto avanzate e sono disponibili molteplici presidi diagnostici e terapeutici estremamente efficaci. È anche uno dei tumori per i quali negli ultimi anni la mortalità si è significativamente ridotta grazie al miglioramento delle tecniche diagnostiche, ma soprattutto grazie alla introduzione di programmi di screening.
Cosa è il colon e dove nasce il tumore del colon
Il colon è la parte finale dell’apparato digerente, il tubo che nasce dalla bocca e termina all’ano per una lunghezza di circa 6-8 metri. Il colon ne rappresenta più o meno il metro finale ed è a sua volta suddiviso nel cieco (a cui è annessa l’appendice), il colon ascendente, il colon trasverso, il colon discendente, il sigma ed il retto (figura 1).

Figura 1: anatomia del colon
Il tumore del colon nasce in genere dalle cellule ghiandolari del rivestimento interno dell’organo e si tratta quindi di un adenocarcinoma. Più rari sono i tumori degli altri costituenti dell’organo (muscoli, grasso, cellule neuroendocrine, etc.). In questa presentazione parleremo dell’adenocarcinoma che rappresenta oggi un vero e proprio problema di salute pubblica.
La gran parte dei tumori, circa i 2/3 dei casi, origina dalla parte sinistra del colon, retto e sigma. Il restante 1/3 dei casi prende origine nei restanti segmenti colici (figura 2).

Figura 2: distribuzione del tumore nei vari segmenti del colon
I polipi del colon and il loro rapporto con il cancro colorettale la pressoché totalità dei tumori del colon nasce come polipi che progressivamente degenerano in tumore.
Si parla di polipo ad indicare una crescita anomala di tessuto che sporge rispetto alla circostante superficie. I polipi si possono formare in vari organi (corde vocali, utero, stomaco, vescica, ad esempio), ma quelli del colon sono particolarmente importanti in quanto possono essere i precursori del tumore; la loro rimozione previene dunque la comparsa del CRC.
I polipi appaiono come delle rilevatezze della superficie del colon di varie dimensioni. Possono essere attaccati alla mucosa da un peduncolo più o meno lungo (sembrano dei funghi) e sono detti “peduncolati” o crescere direttamente dalla superficie mucosa e sono allora detti “sessili”; talvolta si tratta di semplici inspessimenti della mucosa e sono allora detti “lesioni piatte” (figura 3).

Figura 3: Conformazione dei polipi del colon : a) Polipi sessili; b) Polipi peduncolati; c) Lesioni piatte
Dal punto di vista della istologia (ossia la struttura del polipo) si distinguono due grandi categorie di polipi: gli adenomi ed i polipi non adenomatosi. Mentre i polipi non adenomatosi (polipi iperplastici, polipi infiammatori e polipi amartomatosi) non divengono tumori, gli adenomi sono considerati dei veri e propri tumori benigni, in grado di progredire e divenire tumori maligni.
A loro volta gli adenomi possono essere definiti tubulari o villosi e possono presentare una displasia di basso od elevato grado, caratteri questi che definiscono il grado “malignità” del polipo, ossia il rischio che tale polipo possa divenire un tumore (maggiore per i tumori villosi e per quelli con displasia di alto grado).
I polipi possono avere dimensioni da pochi millimetri a vari centimetri; tanto più grande è il polipo tanto maggiore è il suo rischio di trasformazione. Allo stesso modo, tanto maggiore è il numero di polipi tanto maggiore è il rischio di tumore. Esistono delle condizioni in cui si sviluppano decine di polipi. Tali condizioni derivano in genere da mutazioni genetiche e sono in genere ereditarie. Il rischio di trasformazione di questi tumori è in questo caso altissimo.
Fanno parte delle cosiddette polipose ereditarie la poliposi adenomatosa familiare (detta FAP), la sindrome di Gardner, la sindrome di Peutz–Jeghers, la sindrome poliposica giovanile, la serrated polyposis syndrome. I polipi in genere non danno sintomi a meno che non siano di dimensioni particolarmente grandi ed in tal caso possono dare sanguinamento, anemia o raramente ostruzione dell’intestino. Per tale motivo la diagnosi di polipi avviene spesso occasionalmente nel corso di colonscopie eseguite per screening in pazienti asintomatici o in pazienti che si sottopongano all’esame per sintomi non propriamente legati ai polipi.
La colonscopia viene dunque eseguita con lo scopo di riconoscere e di rimuovere tutti i polipi presenti al fine di ridurre il rischio di tumore. La tecnica che consente la asportazione del polipo durante una colonscopia è detta polipectomia. Esistono varie tecniche di polipectomia, la più comune delle quali si basa sullo strozzare la base del polipo con un cappio che poi taglia via il polipo attraverso il passaggio di corrente elettrica. Per lesioni di dimensioni maggiori si usano tecniche più complesse quali la mucosectomia e la dissezione mucosa (figura 4)


Figura 4: Tecniche di asportazione dei polipi del colon: a) Polipectomia con ansa; b) Mucosectomia; c) Dissezione mucosa
Fattori di rischio ambientali
Il tumore del colon è tipicamente causato dalla interazione tra fattori genetici, ambientali e comportamentali.
I fattori che sono stati dimostrati poter influenzare la comparsa del tumore del colon sono:
Età: l'incidenza di CRC aumenta con l'età del soggetto, visto che circa il 90% dei casi insorge in individui di età superiore ai 50 anni, mentre i casi che insorgono nei più giovani sono quelli in cui la predisposizione genetica gioca un ruolo più importante.
Il sesso: il tumore ha una maggiore incidenza nei maschi rispetto alle femmine. Tale differenza è stata attribuita ad un possibile ruolo protettivo degli estrogeni, ma i dati in tal senso non sono ancora ben chiari.
Fumo: I soggetti fumatori hanno una maggiore probabilità di morire per CRC rispetto ai soggetti non fumatori e questo sia per le donne (incremento del rischio nei fumatori del 40%) che per gli uomini (incremento del rischio del 30%).
Dieta: L'alto contenuto nella dieta di carni rosse, soprattutto quelle lavorate, aumenta il rischio di CRC. Dall’altra parte il consumo di fibre e frutta rappresenta un fattore di protezione, così come le vitamine e gli antiossidanti, in particolare la vitamina C, l’acido folico, la metionina, il calcio e la vitamina D. L’obesità si associa ad un aumentato rischio di CRC.
Fattori ambientali: Soggetti residenti in aree industrializzate hanno un rischio maggiore per lo sviluppo di CRC.
Processi infiammatori cronici dell’intestino: la malattia di Crohn e la rettocolite ulcerosa si associano ad un incrementato rischio di tumore e questo rischio è direttamente connesso con la gravità e con l'estensione del processo infiammatorio così come alla sua durata.
Fattori di rischio genetici
In 2/3 dei casi di CRC non si rileva una chiara storia familiare di neoplasia colica. Nel restante terzo dei casi uno o più familiari del soggetto malato ha avuto una neoplasia colica. Questo fatto lascia supporre il ruolo della predisposizione genetica nella genesi del CRC. Nelle persone che hanno 2 o più parenti di primo grado con un tumore del colon il rischio di sviluppare la malattia è aumentata di 2-3 volte. Esistono delle sindromi genetiche che sono associate ad un elevato rischio di sviluppare il CRC. La più comune di questa è la HNPCC (cancro colorettale ereditario non-poliposico o sindrome di Lynch) che rappresenta circa il 3% di tutti i CRC. Altre sindromi più rare sono la sindrome di Gardner e la FAP (poliposi familiare adenomatosa) che rappresentano circa l’1% dei casi di cancro; la possibilità che una persona portatrice di tali sindromi sviluppi un CRC è del 100% e per tale motivo questi paziente devono essere sottoposti alla asportazione di tutto il colon per prevenire la insorgenza del tumore. La più frequente sindrome poliposica è la serrated polyposis syndrome che si associa ad un rischio del 25-40% di sviluppare CRC.
Circa il 20% delle persone che sviluppano cancro del colon-retto ha un precedente caso in famiglia. In queste situazioni, la prevenzione del cancro nei familiari deve avvenire effettuando una colonscopia nei genitori, fratelli e figli dei pazienti.
La colonscopia consente l’individuazione di polipi, ovvero di lesioni pretumorali che possono essere rimosse in corso d’esame e impedire la progressione verso il cancro.
L’età di inizio e la frequenza dei controlli endoscopici devono essere definiti in modo rigoroso. Il suggerimento è di sottoporre a colonscopia genitori e fratelli nel momento della diagnosi di cancro del familiare. Per i figli invece il controllo deve iniziare a 50 anni o – se non li hanno ancora compiuti - ad un’età pari a 10 anni in meno rispetto all’età del genitore nel momento della diagnosi di cancro. Ad esempio, se il tumore è stato diagnosticato all’età di 45 anni, la colonscopia di controllo nei figli deve iniziare a 35 anni.
Se in una famiglia si verificano molti casi di tumore, anche di tipo e sede diversi, può essere presente una condizione riferibile a tumore ereditario.

Il tumore del colon si sviluppa attraverso fasi successive caratterizzate da mutazioni genetiche che inattivano geni onco-soppressori o che attivano proto-oncogeni e che sommandosi nel tempo determinano la progressiva trasformazione in senso neoplastico delle cellule del colon. I geni che vengono mutati nelle forme sporadiche di cancro del colon sono gli stessi che appaiono mutati nelle forme ereditarie. L’85% dei tumori sporadici si determina attraverso la via del gene APC/β-catenina. La mutazione del gene onco-soppressore APC è quello caratteristico della poliposi adenomatosa familiare (detta FAP). Il gene APC produce la proteina APC che impedisce l’accumulo e la traslocazione nel nucleo della β-catenina. Nel nucleo la β-catenina determina la attivazione di proto-oncogeni. L’accumulo di β-catenina può essere anche conseguenza della mutazione del suo gene o in geni di funzione simile all’APC quali AXIN1, AXIN2, TCF7L2 e NKD1.
Un altro gene che è stato legato allo sviluppo del tumore del colon è il TP53 che produce la proteina p53, coinvolta nel monitoraggio della divisione cellulare e nella morte programmata di cellule che abbiano accumulato difetti della via Wnt. Talvolta non è il gene TP53 ad essere mutato ma un altro gene protettivo chiamato BAX.
Altre proteine coinvolte nella morte programmata di cellule i cui geni possono risultare inattivati nel CRC sono il TGF-β e il DCC (Deleted in Colorectal Cancer). Circa metà dei CRC può presentare un gene TGF-β inattivato.
I CRC esprimono un gran numero di geni che appaiono espressi anche in altri tumori. Alcuni di essi, principalmente oncogeni, appaiono tipicamente iper-espressi nel CRC, tra questi i geni per le proteine KRAS, RAF, and PI3K che normalmente stimolano le cellule a dividersi in risposta a fattori di crescita. L’ordine temporale con cui tali mutazioni insorgono è verosimilmente importante poiché, ad esempio, se una precedente mutazione di APC è seguita da una mutazione di KRAS una semplice eccessiva crescita (iperplasia) del tessuto può evolvere in neoplasia.
Tra le varie e molteplici mutazioni conosciute quella del mismatch repair system sembra essere di particolare importanza in quanto responsabile del 15% di CRC. Il paradigma è rappresentato dalla sindrome genetica cancro colorettale ereditario non poliposico. I cromosomi risultano integri e la mutazione avviene a carico dei mismatch repair, geni che codificano per proteine riparatrici del DNA. Questo si traduce in un accumulo di mutazioni durante i processi mitotici, soprattutto a carico del DNA microsatellite (sequenze ripetute di DNA non codificante, ma importantissimo sito di modulazione dei processi di induzione o arresto della trascrizione).
In generale, la progressione da polipo a cancro rappresenta il modello tipico di patogenesi del CRC. La sequenza polipo-cancro descrive le diverse fasi attraverso cui un tumore benigno si forma, si accresce e si trasforma in cancro nel corso di vari anni. Un ruolo centrale in questo processo di trasformazione è dato dalla mutazione di vari geni, dalla loro attivazione/inattivazione epigenetica, dai processi infiammatori locali.
I sintomi del CRC dipendono dalla sede in cui il tumore si è sviluppato e dal grado di avanzamento e diffusione del tumore. I tipici sintomi che devono far sospettare un CRC, soprattutto in una persona di età >50 anni, sono la emissione di sangue dall’ano (proctorragia) e la anemia. Altri sintomi che si associano al CRC, soprattutto del colon sinistro, sono la comparsa di una stipsi o la emissione di feci di forma sottile. Talvolta il primo sintomo di malattia è la comparsa di una occlusione intestinale, caratterizzata da distensione dell’addome, stipsi severa, dolore addominale e vomito. In caso di malattia avanzata può essere presente anemia, dimagrimento, perdita di peso e malessere generale. Una gran parte dei tumori viene diagnosticata oggi in una fase in cui ancora non sono presenti sintomi: questo può succedere in pazienti che si sottopongono allo screening del tumore del colon.
L’ esame più preciso e più frequentemente usato per fare diagnosi di CRC è la colonscopia (figura 6). Questa consente di visualizzare direttamente il tumore, di stabilirne la sede e l’aspetto e di prelevare biopsie, necessarie per avere la diagnosi istologica. La colonscopia virtuale (figura 6), o colon-TC, è un esame che viene talvolta utilizzato come alternativa alla colonscopia, soprattutto sui pazienti che non sono in grado di sottoporsi alla colonscopia per una intolleranza all’esame o una anatomia complessa. Si tratta di una TC addome che viene eseguita dopo una preparazione del colon simile a quella della colonscopia ed aver disteso il colon attraverso la insufflazione di aria. La colonscopia virtuale è un esame molto preciso anche se dotato di una accuratezza inferiore rispetto alla colonscopia convenzionale. Inoltre non consente di eseguire biopsie o di asportare lesioni, per cui molto spesso ad una colonscopia virtuale è necessario far seguire una colonscopia convenzionale per completare la diagnosi e la terapia.
Per ottenere una stadiazione della malattia al fine di pianificare il trattamento più appropriato, la TC addome (figura 6) con mezzo di contrasto è l’esame più usato. Questa consente di visualizzare eventuali metastasi che possano essersi sviluppate in altri organi quali fegato e polmone. La risonanza magnetica della pelvi è in genere utilizzata per i tumori del retto al fine di valutare la estensione della malattia al di fuori dell’organo e pianificare la strategia terapeutica più appropriata (chirurgia, radioterapia, chemioterapia). Anche la ecoendoscopia del retto può essere utilizzata con lo stesso scopo.
Talvolta la diffusione a distanza della malattia viene valutata con la TC-PET.
È possibile determinare con un prelievo di sangue i valori di CEA (antigene carcino-embrionario). Questo marcatore, di scarsa utilità nella diagnosi precoce e nello screening, riveste invece un ruolo importante per valutare la gravità della malattia, poiché la concentrazione è direttamente collegata all'estensione del cancro. Il CEA è anche utile nel monitoraggio della risposta al trattamento farmacologico (scende infatti se la chemioterapia è efficace) o per la verifica della ripresa della malattia (risale in caso di ricadute). Non sempre è però un marcatore sensibile in quanto non tutti i tumori del colon retto lo esprimono. Oltre al CEA può essere utilizzato anche un altro marcatore, il CA 19.9 detto anche GICA, anche se meno specifico perché più indicativo nel cancro del pancreas.
L’analisi del profilo molecolare del tumore, ossia dei geni espressi e delle loro alterazioni, può servire a definire meglio la prognosi e la terapia: alcune alterazioni sono associate a un andamento migliore o peggiore della malattia e alla sensibilità ai farmaci.
A differenza di altri tipi di cancro per i quali esiste una classificazione pressoché univoca, per il tumore del colon-retto si usano diverse forme di classificazione, sulle quali non sempre i medici concordano. La più usata è quella che si riferisce al sistema TNM (dove T sta per la dimensione del tumore, N per il numero di linfonodi coinvolti e M per le metastasi).
Il CRC è un tumore presente in tutto il mondo, ma che colpisce più frequentemente i paesi industrializzati (figura 3) e dunque l’Italia.
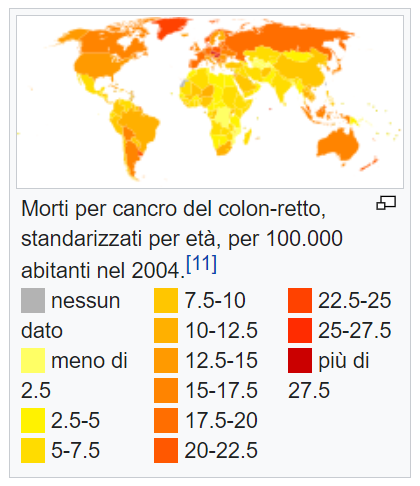
In Italia la incidenza del tumore è di 40-60 casi per 100.000 individui. L’incidenza nel sesso maschile è più alta di un 30-40% rispetto a quello femminile soprattutto per il tumore del retto (rapporto maschi-femmine 2/1).
In entrambi i sessi il CRC rappresenta il terzo tumore più frequente (dopo prostata e polmone nell’uomo, dopo mammella e polmone nella donna). Nell’uomo rappresenta la seconda causa di morte per neoplasia (dopo il polmone), mentre nella donna rappresenta la terza causa di morte per neoplasia (dopo mammella e polmone).
La malattia, abbastanza rara prima dei 40 anni, è maggiormente diffusa in persone di età compresa fra i 60 e i 75 anni, con poche distinzioni fra uomini e donne. In Italia si stima che questo tumore colpisca circa 23.000 donne e 30.000 uomini ogni anno (dati AIRTUM - Associazione Italiana Registro Tumori 2017). L'incidenza è in aumento nella popolazione femminile per via delle abitudini di vita sempre più uniformi tra i due sessi.
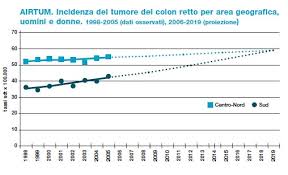
Negli ultimi anni si è assistito a un aumento delle diagnosi di tumori del colon retto, ma anche a una diminuzione della mortalità, attribuibile principalmente ai programmi di diagnosi precoce e al miglioramento delle terapie, sempre più mirate e personalizzate.
La terapia del CRC consta di vari presidi quali la chirurgia, la chemioterapia, la radioterapia e tutte una serie di metodiche da applicare a scopo palliativo.
La scelta di cosa fare dipende naturalmente dallo stadio della malattia (figura 7).
Negli stadi inziali la chirurgia da sola è curativa. Negli stadi più avanzati la chirurgia deve essere seguita o preceduta dalla chemioterapia ed eventualmente dalla radioterapia.
Le tecniche palliative vengono usate nei casi di malattia avanzata e non più curabile o sui pazienti in gravi condizioni cliniche e possono essere orientate al mantenimento della canalizzazione del colon, al trattamento del dolore ed al mantenimento dello stato nutrizionale.
La chirurgia
La chirurgia rappresenta il trattamento basilare per il CRC, in quanto consente la asportazione completa del tumore attraverso la rimozione del segmento di colon in cui esso si trova con i linfonodi ed i vasi vicini. Tale asportazione può essere eseguita per via laparoscopica o con tecnica convenzionale laparotomica. La tecnica di asportazione viene detta colectomia parziale o proctocolectomia nel caso di lesioni del retto. La continuità del colon può essere ristabilita immediatamente dopo la resezione o in un secondo momento previo il confezionamento di una colostomia transitoria (apertura del colon sulla cute). Solo nel caso dei tumori del retto la colostomia può essere definitiva se per asportare il tumore è necessario rimuovere anche la struttura dell’ano.
In taluni casi l’intervento può essere indirizzato anche alla asportazione di metastasi, in genere del fegato.
La chirurgia, può talvolta essere preceduta da una radio e chemio terapia (chiamata terapia neoadiuvante). Tale trattamento viene in genere proposto per I tumori del retto con lo scopo di ridurre la massa neoplastica e permettere una chirurgia che risparmi la regione sfinteriale, evitando così la colostomia definitiva.
La chemioterapia
La decisione di utilizzare la chemioterapia nel CRC dipende dallo stadio della malattia come emerge dagli esami pre-operatori e dall’esame istologico del tumore asportato, in particolare dal grado di infiltrazione del tumore nella parete del colon (figura 7).
Nello stadio I in genere non viene fatta alcuna chemioterapia e la chirurgia rappresenta il trattamento definitivo. Nello stadio II il ruolo della chemioterapia è ancora dibattuto e non viene in genere proposta, a meno che il tumore non sia un T4 (coinvolga cioè tutta la parete del colon), sia poco differenziato, esistano segni di infiltrazione vascolare o neurale o siano stati asportati un numero insufficiente di linfonodi. Nei tumori in stadio III e IV la chemioterapia viene sempre prescritta. La presenza di un coinvolgimento linfonodale o di organi a distanza (stadi III e IV) prevede l’uso di agenti quali il fluorouracile, la capecitabina e l’oxaliplatino, in grado di aumentare la aspettativa di vita del paziente. Nel caso di tumori diffusamente metastatici o non resecabili il trattamento è esclusivamente palliativo e prevede l’uso di diversi farmaci e protocolli, quali capecitabina, fluorouracile, irinotecan ed oxaliplatino,
Questi farmaci vengono somministrati in associazione (definite con sigle che identificano le iniziali dei vari farmaci impiegati, CAPOX, FOLFOX, FOLFOXIRI). Più di recente sono stati introdotti tra i farmaci antineoplastici i cosiddetti antiangiogenetici, quali il bevacizumab, talvolta utilizzato già come terapia di prima linea, e gli inibitori del recettore dell’epidermal growth factor, cetuximab e panitumumab, utilizzati spesso come trattamento di seconda linea.
Nei tumori del retto localmente avanzati la radioterapia viene spesso associata alla chemioterapia (terapia neoadiuvante) al fine di permettere una resezione chirurgica che risparmi l’ano e l’apparato sfinteriale e consenta dunque di evitare la colostomia definitiva. La terapia neoadiuvante consente un downstaging del tumore aumentando la possibilità di ottenere una resezione radicale e riducendo il rischio di recidiva.
L’uso combinato di radio e chemioterapia non sembra essere efficace nei tumori degli altri segmenti colici, in quanto non migliora la sopravvivenza del paziente che invece può sviluppare più effetti collaterali.
I cosiddetti farmaci biologici possono essere associati alla chemioterapia e comprendono, per esempio, farmaci diretti contro il fattore di crescita dell’endotelio vascolare (VEGF) quali il bevacizumab e l’aflibercept, i farmaci contro il recettore per il fattore di crescita epidermoidale (EGFR), quali cetuximab e panitumumab, e il regorafenib, un inibitore delle chinasi. Per l’uso di questi farmaci i pazienti vanno selezionati in base al profilo molecolare del tumore e in particolare alla presenza di mutazioni che indicano la possibile risposta al trattamento. Alcuni farmaci di seconda linea sono utilizzati quando i trattamenti con i farmaci precedenti non sono stati sufficienti a controllare la progressione della malattia metastatica.
Cure palliative
Il trattamento palliativo è indicato in quei pazienti che abbiano una malattia avanzata e non più guaribile o presentino sintomi particolarmente inabilitanti (il dolore ad esempio). Lo scopo delle cure palliative è quello di migliorare la qualità della vita del paziente e dei familiari, trattando i sintomi, l’ansia legata alla malattia e riducendo i ricoveri ospedalieri.
Le cure palliative sono quindi orientate al trattamento di sintomi o complicanze ma non a curare la malattia.
Accanto alle procedure finalizzate al trattamento del dolore e del mantenimento della nutrizione del paziente, comuni a tutte le patologie neoplastiche, esistono procedure specifiche per il tumore del colon mirate al trattamento della ostruzione intestinale. La chirurgia può asportare il tumore ottenendo la ricanalizzazione del colon o può by-passare il tumore attraverso la formazione di una colostomia (apertura dell’intestino sulla parete addominale). In caso di ostruzione intestinale la ricanalizzazione dell’organo può essere ottenuta ponendo in esso una protesi che riapre la stenosi. Talvolta la radioterapia mirata sul tumore può ottenere una riduzione della massa, riducendo così il dolore e riducendo il rischio di emorragia.
Nei tumori del retto, la chirurgia è spesso preceduta da chemio e radioterapia, al fine di effettuare interventi sempre più conservativi e, quando possibile, di evitare la creazione della cosiddetta stomia. La stomia è l’apertura dell'intestino sulla parete addominale con la realizzazione di un ano artificiale, che consente di raccogliere le feci con appositi presidi. In questo caso è fondamentale la riabilitazione sia fisica sia psicologica dei pazienti. Un altro intervento, attuato in casi selezionati, è la resezione di eventuali metastasi al fegato.
Il tasso di sopravvivenza a cinque anni per il carcinoma del colon-retto è inferiore al 60%. La sopravvivenza è strettamente legata alla precocità della diagnosi ed al tipo di tumore (più o meno indifferenziato). Nei casi diagnosticati precocemente i tassi di sopravvivenza sono cinque volte maggiori rispetto alle diagnosi tardive. In particolare, i tumori che appaiono ancora limitati alla mucosa danno una sopravvivenza a 5 anni del 100%, percentuale che scende al 90% in caso di coinvolgimento della sottomucosa ed al 70% nel caso di coinvolgimento di tutta la parete del colon senza coinvolgimento linfonodale. La presenza di linfonodi coinvolti abbassa la sopravvivenza al 40%, mentre la presenza di metastasi a distanza riduce ulteriormente la probabilità di sopravvivenza a cinque anni a circa il 5%.
Tutti questi dati stressano ulteriormente la utilità dei programmi di screening che, anche quando portano alla diagnosi di un tumore, ne permettono il riconoscimento in una fase precoce e quindi con maggiori chance di cura.
Tra i fattori di rischio legati allo stile di vita, la dieta rappresenta uno dei più studiati. Una dieta ad alto contenuto di grassi animali e proteine sembra favorire la trasformazione maligna di eventuali polipi del colon preesistenti. Questo non sembra avvenire con i grassi vegetali, insaturi.
Le fibre alimentari, in particolare quelle che non vengono digerite come la crusca, sembrano avere un effetto protettivo. Si è osservato che le popolazioni vegetariane hanno un'incidenza di carcinoma del colon-retto ridotta del 30 per cento.
Difficilmente la dieta è l'unica causa di un tumore del colon, ma può contribuire allo sviluppo della patologia insieme ad altri fattori di rischio.

Circa il 50% dei CRC si sviluppano a seguito di stili di vita sbagliati, la cui correzione potrebbe ridurre di almeno il 25% l’incidenza del tumore.
Esiste una forte evidenza che la sedentarietà, il fumo di sigaretta, l’uso di alcol e l’obesità possano aumentare il rischio di CRC. In aggiunta è stato suggerito che una dieta ricca in fibre vegetali, cibi integrali, frutta e verdura, e povera in grassi animali e carne rossa e lavorata possa determinare una riduzione del rischio neoplastico
É stato dimostrato che l’aspirina ed i farmaci antiinfiammatori come il colecoxib possono ridurre il rischio di tumore del colon negli individui ad alto rischio.
Alcuni dati suggeriscono che anche il calcio e la vitamina D possano avere un effetto protettivo.
La colonscopia come primo esame di screening viene proposta ogni 10 anni, in genere non nell’ambito di programmi organizzati (in quanto estremamente costosa), ma in quello che viene definito “screening opportunistico”, ossia screening proposto su base individuale dal medico al paziente che si trovi in una età a rischio e che non presenti sintomi specifici.
Esistono anche altre tecniche proposte per lo screening quali la colonscopia virtuale (una TAC addome che consente di avere immagini molto precise del colon, ma che è costosa ed espone a radiazioni) ed il test del DNA sulle feci (FIT-DNA). Il FIT-DNA ricerca nelle feci vari marcatori genetici di CRC ed in caso di positività va fatto seguire da una colonscopia. Si tratta di una metodica sperimentale non ancora entrata nella routine.

Screening
Poichè la maggior parte dei CRC si sviluppa a partire da un polipo ed il tempo che un polipo impiega a divenire un cancro può essere di 5 -15 anni, la applicazione di programmi di screening può consentire il riconoscimento di lesioni ad uno stadio iniziale, tale da permettere la interruzione della trasformazione del polipo in tumore, attraverso la sua rimozione, o la cura del tumore in uno stadio iniziale. In tal modo lo screening ha la potenzialità di ridurre sino al 60% il numero di morti per CRC.
Le 3 principali modalità di screening sono rappresentate dalla colonscopia diretta, dalla ricerca del sangue occulto fecale seguito dalla colonscopia e dalla sigmoidoscopia (ossia la esplorazione endoscopica della metà sinistra del colon). Ogni metodica presenta vantaggi e svantaggi in termine di efficacia, costi e fattibilità con la sigmoidoscopia che ha attualmente i dati più robusti in termine di riduzione di mortalità per tumore.
Il sangue occulto fecale (detto FOBT) è la metodica più usata nel mondo; in Italia tale pratica viene eseguita in tutte le regioni con la eccezione del Piemonte e di parte del Veneto dove si esegue la sigmoidoscopia. Il FOBT viene fatto ogni 2 anni e viene seguito da una colonscopia se risultato positivo. Esistono due modi per determinare il FOBT, quello basato sul guaico e quello immuno-chimico. Quest’ultimo è quello usato in Italia. Si calcola che tale pratica possa ridurre del 25% la mortalità per tumore.
La sigmoidoscopia, secondo il programma piemontese, viene eseguita una volta all’età di 58 anni ed ha la capacità di ridurre del 40% la mortalità per CRC.